
 2023-12-09
2023-12-09
金刚石电极和生物传感器因其独特的特性而在分析中引起人们的关注,即:大电位窗口、化学惰性、低基线电流、稳定性和透明度。金刚石电极和生物传感器被证明可以分别检测神经递质和蛋白质等生物分子。在这篇综述中,我们根据检测类型(电化学或光学)、功能化和目标分析物总结了不同类型的金刚石电极和生物传感器。最后一部分讨论了根据分析物的类型,使用电极或生物传感器获得的不同分析响应。电极非常适合检测具有氧化还原特性的小分子,而生物传感器更适合检测高分子量分子,例如 DNA 和蛋白质。
01/介绍:一般来说,生物传感器是由受体层 (RL) 和传感器组成的装置,如图 1 所示。与目标分析物(例如 DNA、蛋白质、脂质、糖类)的溶液接触后,它会结合 到 RL,传感器通常将事件转换为输出信号,例如光学、热、压电、电化学或电化学发光信号等。
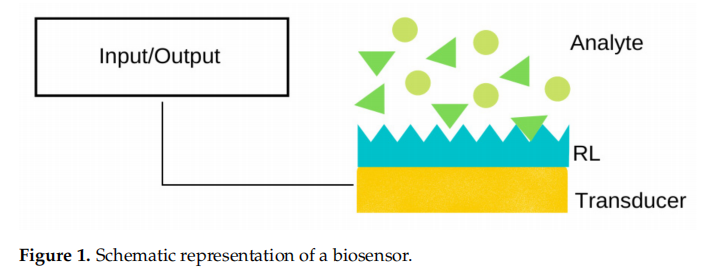
金刚石具有一系列独特的化学和电子特性,使其成为生物传感器传感器层成分的一种很有前景的材料。化学惰性使金刚石薄膜可以安全地用于生物应用,而金刚石固有的硬度和机械强度使金刚石能够安全地用于生物应用。基于传感器的传感器非常耐用,并且可以在高或低 pH 介质等腐蚀性条件下运行。
天然金刚石是一种绝缘体,具有很宽的带隙(5.5 eV)和极高的电阻率(1016 0cm),阻碍了其在电子领域的应用。反过来,在氢饱和条件下通过化学气相沉积 (CVD) 沉积的合成金刚石呈现出低得多的表面电阻率,其值约为 10% 0cm。金刚石的电导率可以通过在 CVD 过程中加入晶格选择的杂质(例如硼、氮和磷)来进一步调整。
图 1 所示的目标特异性受体层可以通过具有能够连接生物分子的氨基或羧基悬垂部分的氢封端 CVD 金刚石膜的功能化来实现。光化学方法(例如烯烃)或电化学修饰(通过重氮盐的还原)是将这些待定基团附着到金刚石表面的最常见方法。接下来是第二个反应步骤,其中将互补生物分子(针对目标分析物)连接到这些连接体上,从而为金刚石层提供高灵敏度和特异性。这篇综述描述了制造基于金刚石的生物传感器的主要方法,并组织了 如下:第 2 部分描述了通过 CVD 沉积的金刚石薄膜的特性以及使用等离子体处理对其表面进行功能化;第 3 节概述了金刚石膜表面改性中使用的光化学、电化学和绿色化学方法;第 4 节和第 5 节分别描述了基于金刚石的电化学传感器和具有金刚石受体层的生物传感器的实际应用。我们注意到,传感设备是根据分析物的类型列出的,电极用于分析小的氧化还原活性生物分子,如组胺、多巴胺和其他神经递质,而具有较大表面积的生物传感器则用于识别 生物分子,例如 DNA 和蛋白质。在审查结束时,对这些不同类型的探测器的优点和缺点进行了比较。
02/化学气相沉积金刚石薄膜
金刚石薄膜可以在氢饱和的含碳气氛中通过 CVD 沉积在各种非金刚石基材上。后者起着举足轻重的作用:一方面,氢原子在烃源和金刚石基底上产生自由基;另一方面,它们以比 sp2 杂化碳(金刚石)更高的速率蚀刻掉 sp2 杂化碳(石墨),从而生长出高质量的金刚石薄膜。氢原子进一步稳定了金刚石表面的悬挂键,这是金刚石一些最独特性质的根源,例如高化学惰性、大电位窗口、疏水性和负电子亲和力 (NE A)。天然金刚石是一种 绝缘子。当薄膜在富氢环境中通过 CVD 沉积时,它们表现出被认为是表面导电性的特性。发生这种情况的原因是碳的电负性比氢稍大,导致形成致密的表面偶极层,其中碳原子(C-)带有轻微的负电,氢原子(H+)带有轻微的正电,这会导致垂直于 表面在 C-H 键长量级的距离上,即 1.1 A。该偶极子上的能量变化在 1.6 eV 范围内。金刚石的电导率可以通过在其晶格中包含电荷载流子元素(例如硼、氮和磷)来进一步调整。用硼掺杂金刚石使其成为 p 型半导体,活化能 (Ea) 为 0.37 eV,而用氮掺杂金刚石可以获得 n 型半导体,Ea = 1.7 eV,或磷,E = 0.56 eV 金刚石薄膜的表面通常是多晶的,晶粒尺寸在微米范围内。CVD 技术的多功能性允许制备多层材料,只需改变气体环境的成分即可将掺杂层和未掺杂层沉积在彼此的顶部,从而可以制造具有定制特性的薄膜。例如,可以通过在掺硼多晶薄膜顶部生长一层薄层非掺杂纳米晶金刚石来改善材料堆叠的电性能(图 2)

当未掺杂的纳米层沉积在导电多晶金刚石的基层上时,组合材料可以用作电极,从而提高对小生物分子的选择性。文献示例报告了在 20 Torr50 sccm CH4、200 sccm H、2 sccm C,H、基底偏压 -200 V 和基底温度800℃ 2 小时的条件下,在掺硼金刚石上沉积纳米晶金刚石)。 最近,Song等人表明可以从未掺杂的金刚石开始并使用二次沉积来进行硼掺杂来生产硼掺杂金刚石(BDD)。正如预期的那样,BDD 样品呈现出金刚石薄膜所不具备的电化学特性。随着掺杂层厚度的增加(通过增加掺杂时间),电位窗口增加,但电化学活化没有变化,因为这是表面现象。
金刚石薄膜的等离子体处理,金刚石薄膜的表面通常含有氢原子(H-金刚石)。 然而,可以生产带有其他末端基团的金刚石薄膜,从而影响电子亲和力、表面电导率和润湿性等特性,并最终改变其吸附和附着分子、细胞和细菌的能力。氧气和氮气是其中的两种。 金刚石表面最常见的末端基团 这种终止可以通过将金刚石暴露在允许它们与金刚石表面反应的条件下的选定气体气氛中来实现。用 O 原子代替 H 原子可以通过暴露于氧气,或由射频(RF)等离子体或通过在氧气气氛中的热氧化产生的原子氧。 与原始 H 金刚石不同,金刚石表面富含氧,具有亲水性,并具有正电子亲和力 (PEA)。 其电化学性质(即电子转移动力学和电势窗口)与氢金刚石表面的电化学性质不同。虽然氧末端原子的存在保证了亲水性表面,但氮末端原子的存在带来了额外的优势,即允许 DNA 和肽等生物分子的共价结合。 与氧化过程类似,可以通过在 He/NH3 或 N2 气氛中进行 RF 等离子体处理来实现在金刚石表面上包含氮原子。 后一过程可以产生多种键合构型,例如C=N、C-N和C-NH2。
03/金刚石薄膜的表面改性:除了等离子体处理之外,还可以使用各种技术(例如光化学和电化学功能化)将特定分子附着到金刚石薄膜的表面。“更绿色”的化学方法已在文献中得到进一步报道。
光化学反应:在氢金刚石表面包含不同官能团的最早方法之一是采用光化学引发的过程。在这些技术中,利用紫外光将简单的 NH 基团或桥接分子(例如酸或胺封端的烯烃)附着到金刚石薄膜的表面(图 2)。桥接分子产生一个间隔臂,随后可以与目标特定分子(例如 DNA 寡核苷酸链或蛋白质)形成共价键。此外,光化学方法的表面改性比湿化学改性具有优势,因为它可以轻松地用官能团对基材进行图案化。作为一个挫折,氨基烯烃中存在两个不同的官能团,例如一端是双键,另一端是胺,需要使用保护基团以确保光化学反应与双键位点发生并 避免胺头基团发生反应,这可能导致基材蚀刻。
最简单的功能化形式涉及在金刚石中生成 Nho 端接表面。这些可以通过在450W汞弧灯(254nm)照射下将H-金刚石暴露于氯气,随后也在照射下将氯封端暴露于氨气来获得。两个反应均在低压(约 10-7 atm)下进行。
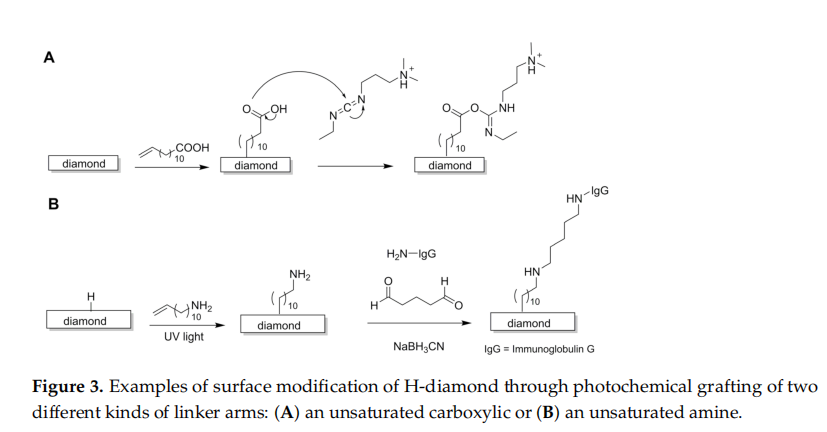
为了更好地容纳 DNA 等大分子,优选使用间隔臂的方法。第一份关于用 DNA 寡核苷酸序列功能化纳米晶金刚石膜的报告可以追溯到 2002 年,并采用 10-氨基癸烯(胺基受三氟乙酰胺保护)通过紫外线照射(0.35 mW cm-2, 254 nm)。脱保护后,使伯胺与异双功能交联剂磺基琥珀酰亚胺-4-(N-马来酰亚胺甲基)环己烷-1-甲酸酯(SSMCC)反应,形成随后与硫醇修饰的DNA寡核苷酸链反应的基团。
或者,DNA寡核苷酸链可以通过另一端以羧酸基团封端的烯桥连接至H-金刚石。常用的连接剂是10-十一碳烯酸,它通过紫外线照射(20 h2.5 mW cm-2, 254 nm)活化反应形成桥接层;随后,用 1-乙基-3-[3-二甲基氨基丙基]-碳二亚胺 (EDC) 处理游离的羧酸根基团,生成易于与所需 DNA 寡核苷酸的胺基反应的非活性中间体物质(图 3A)。用 EDC 活化羧酸基团可以实现更快、高强度的反应,因为活性中间体比天然 COOH 更具反应性。该方法的进一步开发比较了未保护和受保护形式(十一碳烯酸三氟乙酯)的 10-十一碳烯酸的反应效果,结果表明,保护基团的使用导致金刚石表面上的羧酸酯基团密度较低。这可能是由于受保护分子的体积较大,对官能化反应产生空间位阻,从而降低了附着分子的密度。
H-金刚石表面包含抗体的过程与已经描述的 DNA 类似,其中第一个反应步骤采用三氟乙酰胺保护的 10-氨基癸烯(图 3B)。第二步,用戊二醛溶液处理底物,戊二醛是一种蛋白质交联剂,能够与胺反应形成席夫碱。然而,该方法需要额外的处理步骤(在氰基硼氢化钠偶联缓冲液中添加 0.1 M 甘氨酸溶液)以去除可能影响金刚石表面稳定性的未反应的醛基。
电化学反应:这些程序基于带电分子通过电流与氢金刚石表面的反应。
涉及重氮盐的反应:Kuo 等人首先报道了苯基重氮盐的使用。1999 年,该方法迅速成为一种广泛采用的金刚石表面功能化方法,其连接臂可作为生物分子(如抗体或 DNA 寡核苷酸链)共价键合的锚点。该过程从合成重氮盐开始,例如四氟硼酸 4-硝基重氮苯(图 4),然后在 1% SDS(钠)溶液存在下用于处理 H 封端金刚石薄膜 (40 mM) 十二烷基硫酸盐)以产生以4-硝基芳基基团封端的表面。随后施加电流将硝基还原为伯胺。
通过苯基重氮盐法在金刚石表面形成的伯胺可用作多种分子的锚定点。一个例子是通过 SSMCC 交联与硫醇修饰的 DNA 寡核苷酸进行反应(DNA 与 NH 封端的金刚石交联的过程的详细信息已描述,见第上一节)。该方法的一个缺点是,苯基自由基物质不仅与金刚石膜的表面反应,而且与接枝在表面上的苯环反应,最终形成不期望的多层。
原位电化学聚合:可以微调电化学反应以实现原位聚合物沉积。一个例子报道了使用吡咯(一种带正电荷的分子)来形成聚吡咯薄膜:将金刚石表面浸入 50 mM 吡咯在 0.2 M KCl 中的溶液中,并从 0 到 1.1 V 循环两次(扫描速率为 500 mV s-')。随后的氧化(通过添加 0.5 M NaOH 并应用十次电循环)促进了 COO- 基团的形成,从而形成具有多个负电荷的聚合物涂层。据报道,该方法可改善多巴胺等小生物阳离子分子的检测。
离子液体促进的反应:迄今为止报道的大多数方法都依赖于使用外部能源(射频/紫外线的热能/电能)来提供所需的活化能,以在金刚石表面上的原子与不同化学实体之间建立键。已经提出了使用重氮盐对带有氢原子的金刚石薄膜表面进行化学改性的新视角,并使用离子液体。该过程可以在不使用任何活化源的情况下进行,即无需热、电或光化学活化。在他们的报告中,Szuneritsetal。仅使用溶解在离子液体中的 4-硝基偶氮苯,利用其低蒸气压的优势:通过使用简单的点样技术,将重氮盐离子液体溶液的液滴局部沉积在碳材料上,为化学功能化开辟了新的机会 金刚石表面。
04/ 金刚石基电极
掺硼金刚石 (BDD) 电极因其独特的电化学特性(例如低且稳定的基线电流和宽的水分解电位窗口)而越来越多地应用于生物分析应用。化学稳定性是一个关键因素:虽然大多数常用电极不能在腐蚀性、酸性或碱性介质中使用,但金刚石电极的化学惰性使其可以在各种类型的介质中使用。另一个好处是“防污”行为,即它们对大多数类型的有机分子的吸附性较差,这确保了非常好的稳定性,防止由于表面钝化层堆积而导致电化学信号随着时间的推移而退化。
据报道,金刚石电极可以检测多种生物胺,包括多巴胺、肾上腺素、去甲肾上腺素、血清素和组胺等神经递质。这类分子的检测通常基于它们的氧化反应,其中儿茶酚的醇部分转化为酮。本节中描述的电极通常不会针对目标特异性分析进行功能化,而是通过找到所需分析物的氧化(或还原)峰值电压,然后在电流分析模式下操作来获得其灵敏度。即将电压固定在先前确定的值 最优值。通过简单的涂层程序可以提高灵敏度,例如使用氧化聚吡咯聚合物来排斥阴离子污染物,或者通过用纳米颗粒重塑电极表面来缩小目标分析物的氧化还原峰。通过将电极与毛细管电泳或流动注射分析等分离方法结合可以提高特异性
组胺检测:使用循环伏安法和流体动力伏安法研究了多晶 BDD 薄膜电极在 pH 为 7.2 的水介质中对他胺的电化学响应。组胺的循环伏安图清晰可见,峰值电压为 1.40 V,检测限为 1 µM,组胺浓度的线性响应范围为 0.5 至 100 ul。
血清素检测:前一小节中描述的相同 BDD 薄膜适用于血清素的检测。循环伏安图显示出明确的扫描,峰表明电极表面上没有吸附血清素的氧化产物。在整个实验期间(几个小时)始终没有观察到电极结垢或失活。线性动态范围在 0.01 至 100 µM 区间内,检测限非常低,约为 10 nM。
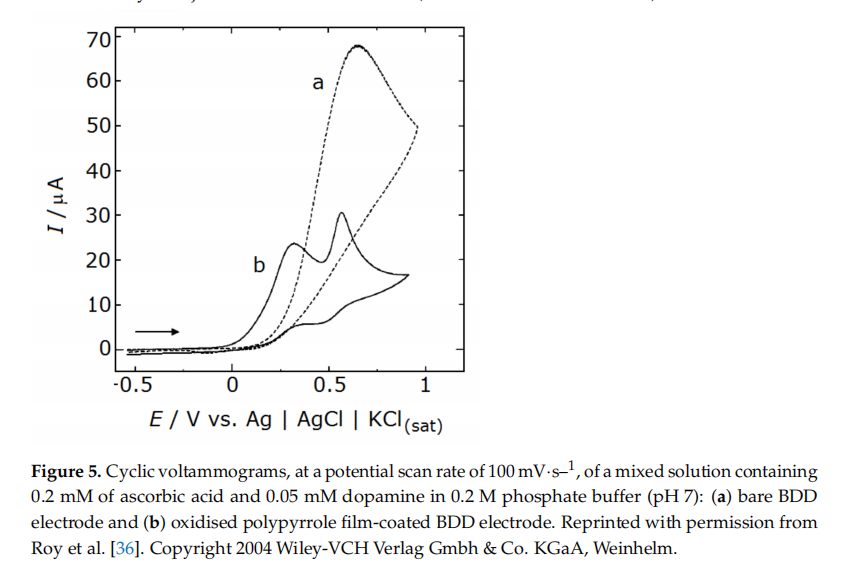
多巴胺检测:多巴胺的伏安检测是通过由 BDD 薄膜制备的微电极实现的,并通过二次沉积工艺进行修改(参见第 2 节中的详细信息,以展示纳米级未掺杂晶体金刚石的外层。该策略有助于缩小多巴胺的氧化峰 ,使其可以从两种常见干扰物抗坏血酸和尿酸的信号中辨别出来。请注意,当金刚石电极未经处理(第二次沉积)以呈现纳米晶体特征时,这两种干扰物的峰与多巴胺的峰重叠 检测含有其他污染物的溶液中的多巴胺的另一种策略是使用沉积在微纤维上并涂有氧化聚吡咯聚合物层的 BDD 电极(参见第 3.2.2 节中的制造细节)。氧化聚吡咯涂层的存在有助于减少 这种干扰源自抗坏血酸和 3,4-二羟基苯乙酸 (DOPAC)(多巴胺的常见代谢物)。这种行为与电极表面氧化聚吡咯涂层中大量带负电的羧酸根基团有关,其吸引多巴胺阳离子,同时排斥带负电的抗坏血酸阴离子。即使目标分析物中存在过量的抗坏血酸 (0.2 mM),多巴胺 (0.05 mM) 伏安图也显示出两个独立的峰,一个为多巴胺,电压为 0.5 V,另一个为抗坏血酸,电压在 0.3 V 左右(图 5) 多巴胺的检测值为0.1 nMatS/N = 3(S/N为信噪比),线性动态范围在0.5 nM至100 uM之间。0.5 nM 多巴胺的电流响应显示出高稳定性,相对标准偏差为 5.4%(n = 5)和良好的重现性(对于 1 nM 多巴胺溶液,在 ± 6.2% 范围内(对于 n = 10))。此外,在 7 天的测量期间,响应保持不变,干扰物(抗坏血酸和 DOPAC)的排斥效率没有变化。
使用耦合系统可以进一步提高含有复杂背景的基质中对多巴胺的敏感性。在其中一份报告中,使用 BDD 微电极对多巴胺进行电流检测,并使用流动注射分析进行预处理。即使分析物溶解在河水和人血清等复杂基质中,该系统也能在低至 6.0 µM(最低测试浓度)的浓度下以良好的可靠性和重现性检测多巴胺。在另一份报告中,使用 BDD 微电极与毛细管电泳结合进行多巴胺的电化学检测。该系统可以分离和分析含有多巴胺、儿茶酚和抗坏血酸的混合物中的多巴胺(磷酸盐缓冲液中的浓度均为 10 mM,pH = 6)。在不同的应用电位下评估系统性能,结果表明背景电流 (~100 pA) 随着时间的推移非常稳定,并且混合物中每种成分的洗脱和检测时间(峰值电流或面积)具有良好的重现性。响应精度优于 4.1%,线性响应在 0.1 至 1 mM 之间,检测限为 1.7 fM。
多成分分析:多巴胺、肾上腺素和去甲肾上腺素Multi-Component Analysis: Dopamine, Adrenaline and Noradrenaline
据报道,与先前描述的类似设置,即由掺硼微电极与毛细管电泳相结合组成,可以同时检测三种主要神经递质:多巴胺、肾上腺素和去甲肾上腺素。该系统对这三种儿茶酚胺具有较高的分离效率和良好的检测性能,对儿茶酚胺混合物进行十次重复检测(每次浓度为50 µM),电流响应具有较高的重现性,检测限低至20 nM。
大量体内应用:切除组织中的去甲肾上腺素和腺苷检测
去甲肾上腺素 :为了使传感器更接近活体生物体中的实际应用,开发了金刚石涂层碳纤维微型传感器,并在体外环境中用切除的大鼠肠系膜组织进行了去甲肾上腺素检测测试。对肠系膜进行电刺激(20 Hz 下 60 个脉冲,总时间为 3 秒,10 分钟后重复刺激),去甲肾上腺素从支配肠系膜动脉的交感神经中释放出来,并以电反应的形式进行测量,呈现出约 100 kHz 的峰值10 帕。随着时间的推移,响应表现出良好的再现性和可回收性。
腺苷 Adenosine:腺苷除了是 DNA 的基本成分外,还以低浓度(约 50 至 200 nM)存在于大脑中,参与神经传递调节,尤其是呼吸功能的控制。在一项试点研究中,Xie 等人。重点研究了啮齿动物大脑中的 PreBotzinger 复合体,该部位富含腺苷释放神经元。该脑区域的切除切片保存在人工脑脊液(含有 8 mM K+)中。测量采用生长在钨微电极(直径约为 30 µm)尖端的 BDD 薄膜,该薄膜可检测浓度为 10 nM 的腺苷,信噪比为 20,检测限为 2nM(信噪比=3)。当将微电极放置在用合成药物刺激释放腺苷的切除脑组织切片上时,能够检测到浓度在 2 至 5 µM 之间波动的腺苷释放。
检测 NADH(腺嘌呤和烟酰胺的二核苷酸):烟酰胺腺嘌呤二核苷酸 (NADH) 由通过磷酸基团连接的两个核苷酸组成。这种细胞代谢必需的生物分子参与多种细胞氧化还原反应,包括柠檬酸循环和氧化磷酸化链,这是活细胞能量产生的两个重要过程。使用 BDD 薄膜电极实现了 NADH 的检测,即使在低 NADH 浓度 (0.2 mM) 下也具有清晰的伏安图,具有良好的电流分析性能和 10 nM 的检测限(信噪比为 7)。发现电极响应在长达 3 个月的储存期内保持稳定。
体内运行的谷胱甘肽电极:谷胱甘肽是一种氧化还原活性三肽,序列为 L-y-谷氨酰-L-半胱氨酰甘氨酸,是负责去除可能对活组织造成损害的氧化物质和自由基的主要生物分子。据报道,BDD 可在小鼠模型体内检测 chimico 和 mbox 中的谷胱甘肽。在稀释的磷酸盐缓冲液 (PBS) 中的谷胱甘肽溶液中进行的电流测量显示,S/N = 3 时谷胱甘肽的检测限为 0.3 mM。体内测量是在患有源自人类癌细胞的异种移植肿瘤的免疫缺陷小鼠中皮下进行的。由于肿瘤细胞代谢率增加,谷胱甘肽通常在肿瘤细胞中过度表达。该电极能够以高重现性检测癌组织和健康组织之间谷胱甘肽浓度的差异。
05/金刚石基电生物传感器
使用特定检测器层对金刚石薄膜表面进行功能化的可能性为检测更大且特定的分子(例如 DNA 甚至病毒)打开了大门。这些生物传感器的工作原理是基于目标分子和受体层之间发生分子间相互作用,从而提高了选择性。在表面上使用多于一种类型的受体分子可以生产能够检测多种分析物的传感器。此外,当分析物的分子被受体层上的对应物识别时,超分子相互作用会导致生物传感器表面电特性的变化,从而允许除循环伏安法之外的其他询问技术,例如阻抗 测量。通过专门探测表面阻抗的变化,这些测量可以提供更准确的工具来检测分析物分子的存在。
DNA 生物传感器:Yang等人通过频率相关的阻抗测量观察了金刚石薄膜表面 DNA 寡核苷酸的识别。作为电势函数的测量表明,106 Hz 下的阻抗主要由金刚石薄膜的空间电荷区域决定,并且互补 DNA 寡核苷酸的杂交能够在金刚石空间电荷层中诱发场效应。这种效应改变了金刚石膜的阻抗,从而允许实时杂交依赖性响应。Zhong等人。使用两种类型的金刚石薄膜测试了 DNA 的电检测,一种由非掺杂金刚石组成,另一种由掺杂浓度高于 1019 cm-1 的 BDD 组成。两种薄膜均采用十一碳烯酸进行功能化,随后连接 DNA 探针链。有趣的是,通过阻抗测量监测 DNA 识别表明,在基于 BDD 的生物传感器上 DNA 杂交后,阻抗变化不大,而由非掺杂金刚石构建的 DNA 传感器则表现出阻抗响应的明显降低。这被解释为“双链 DNA 7t-nt 堆叠后分子层的电荷转移电阻降低,以及由于空穴积累导致的表面下损耗减少”。Vermeeren 等人报道了十一碳烯酸/DNA 功能化非掺杂纳米晶金刚石薄膜。该装置的运行方式与Yang等人构建的装置类似,即当添加互补的靶DNA时,它表现出阻抗的降低。进一步的测试包括使用含有与受体层不互补的 DNA 序列(具有单核苷酸错配或1个错配)的溶液来挑战生物传感器,以研究它是否可以与目标分析物区分开来。结果表明,在 100 至 1500 Hz 之间的频率下,可以区分 1-错配和互补靶 DNA。然而,生物传感器在广泛的应用中仍然表现出一些局限性,因为它的性能因样品介质的低离子含量而受到负面影响。1x PBS 缓冲液中的杂交不成功,而当使用浓缩缓冲液、10x PCR 缓冲液(30 °C)时,互补杂交曲线和 1-错配杂交曲线之间的分离非常清晰且可重复。
免疫球蛋白生物传感器:2007 年首次报道了使用由金刚石薄膜制成的生物传感器检测抗原-抗体识别,该方法采用免疫球蛋白 G/抗免疫球蛋白 G 抗原-抗体系统的电阻抗测量 (29]。免疫球蛋白 E (lgE) 的生物传感器 随后 Tran 等人报道了这一点(55 不是使用天然抗 IgE 抗体,而是采用了一种替代方法,该方法采用一种较小的合成生物分子,称为适体,用于通过十一碳烯酸桥接的受体层)。适体是寡核苷酸或肽链,旨在识别 DNA 或蛋白质。适体是一条合成的寡核苷酸链,富含 20 个胸苷碱基的末端序列,可最大限度地灵活结合 lgE 蛋白质。生物传感器提供 0.03 ug/mlat S/N = 3) 的低检测限和线性动态 范围在 0.03 至 42.8 ug/mL 之间。可重复使用性测试了六个周期,相对标准偏差(第六个周期后)四舍五入到%。该生物传感器的实用性在人血清样本中进行了测试,结果显示,lgE 浓度高达 5.8 ug/mL 时呈线性剂量响应,生物传感器提供的定量数据与参考方法酶提供的定量数据之间的相关系数为 0.99。连锁免疫吸附测定(ELISA)
流感生物传感器:检测 M1 蛋白作为通用流感生物标志物
甲型流感病毒基质蛋白 M1 是一种含量广泛的膜相关蛋白,位于病毒颗粒的包膜下,有助于维持结构完整性并参与病毒生命周期的几个重要过程。当释放到血清中时,M1 蛋白可以聚集并帮助病毒的各种成分组装形成新的病毒颗粒。M1 可作为流感感染的生物标志物进行监测,与其他抗原蛋白相比具有重要优势,因为它横向于流感病毒的所有血清型。流感 M1 蛋白的生物传感器是由纳米晶体BD金刚石薄膜构建而成,该薄膜通过重氮盐电沉积而具有多克隆抗体功能。该生物传感器能够通过在补充有 0.5% Triton Xa 非离子表面活性剂的 PBS 中进行阻抗测量来检测 H1N1 in.luenza 菌株中的 M1 蛋白。在这些条件下,传感器响应在 5 分钟内稳定,线性范围为 10 至 100 fg/mL,检测限低至 0.7 fg/mL,相当于大约 40 个病毒颗粒。该生物传感器还能够在相同条件下检测 H3N2 菌株,阻抗反应几乎没有变化。
通过血凝素 (HA) 识别检测整个流感病毒颗粒Detecting Whole Influenza Viral Particles via Hemagglutinin (HA) Recognition
流感全病毒颗粒的生物传感器是由 BDD 薄膜构建的,该薄膜通过重氮盐的电化学沉积以及随后的唾液酸模拟二聚肽的附着而功能化。该肽设计用于识别血凝素 (HA),流感病毒的表面抗原之一。第一个序列的测试表明,生物传感器在电阻抗光谱模式下运行时,确实能够识别 PBS 溶液中的纯 HA。该生物传感器使用完整病毒颗粒进行了测试,已证明能够成功响应浓度范围为 400-8000 pfu/mL(其中 pfu 是空斑形成单位)的 botlH1N1 和 H3N2 病毒株。
06/ 讨论及未来展望
使用基于金刚石的设备对生物分子进行电检测可以使用简单的电极或特定目标的生物传感器来完成,正如本工作中所回顾的那样。由 BDD(第 4 节)构建的电极可以作为生物分析中实用、有弹性和可重复使用的仪器 由于其独特的电化学特性、化学稳定性和“防污”行为,它们在应用中得到了广泛应用。与第 5 节中描述的生物传感器不同,这些电极没有针对特定目标分析进行功能化,它们的优化是通过找到所需的氧化(或还原)峰值电压来实现的。这提出了明显的选择性问题,特别是对于第 4.1-4.4 节中描述的电极,这些电极仅在 chimico 中进行评估,即仅包含目标分析物或分析物与或的混合物的缓冲溶液。两种常见的干扰物。它们在生物体液等复杂生物基质甚至活组织中的操作能力仍有待证明,对于那些想要在该领域进行进一步研究的人来说,这是一个重要的研究目标。第二个重要问题是它们的灵敏度(LOD 和/或线性范围),因为生物胺在人体内的存在量非常低。血浆多巴胺水平在 0.05 至 0.3 nM 之间,而血浆去甲肾上腺素水平在 0.9 至 8 nM 之间。这些值低于或非常接近电极的线性响应范围,因此意味着它们对血浆样品的实际情况的适用性将需要预处理步骤以增加分析物的浓度或改善其性能。Roy 等人采用的方法。遏制这些问题的一个可能策略是:通过在电极表面涂覆阴离子聚合物,LOD 成功降低至 fenomolar 范围;然而,线性响应范围仍然相当高,在微摩尔范围内,值得进一步改进。de Brosse 等人最近提出了克服敏感性降低的最新策略。60使用油膜复合保护室,可以减轻生物流体或亲水性溶质和溶剂的干扰。与传统电极(即那些没有被膜/油覆盖的电极)相比,这种油膜保护可以将两种标准无机化合物六氰基铁酸盐 (II/III) 和六氨合钌 (II/Ill) 的 LOD 降低 100 倍以上)。虽然这一概念仅针对两种无机标准品进行了论证,但它是一种创新且有前途的方法,用于检测生物流体中的生物分子,且性能下降的干扰效应较少;此外,它不需要改变生物传感器系统本身,而是需要针对每个特定应用仔细选择半透膜和成分。第 4.5-4.7 节中描述的电极构成了有趣的证明 -应用基于金刚石的生物发射器传感装置的概念。腺苷电极,由 Xie 等人测试。对切除的大鼠脑组织进行检测,并显示其在纳摩尔范围内工作,也可用于监测血浆腺苷水平,通常在 0.6-1.1 mM 左右。NADH 传感器(第 4.6 节)也在纳摩尔范围内工作。应进一步强调 给予 Fierroet 等人转发的电极(第 4.7 节),该电极已被证明可以在体内运行,并在癌症检测中取得有希望的结果。
对于基于金刚石的生物传感器,响应的特异性是通过设计实现的,因为响应依赖于分析物和有机受体层上的互补生物分子之间的特定相互作用。这两种生物分子(RL 处的共价键和目标分析物)之间发生的超分子识别产生了电极无法比拟的高度选择性。生物传感器的另一个优点是它们可以用非常少量的物质进行操作。样品:可以将一滴溶液简单地放置在基于金刚石的生物传感器的受体层上。此外,具有电化学检测功能的碳制生物传感器已被用于检测高度增殖的细胞,例如人乳腺癌分离细胞系(MDA-MB-231)、乳腺癌分离细胞系(MCF-7)和肝细胞癌分离细胞系(HepG2), 正如 Suhito 等人所描绘和总结的那样,显示出碳基材料不仅在检测生物分子方面具有巨大潜力,而且能够提供无标记、非侵入性和非破坏性的方法来检测早期癌症 。这可能是未来掺硼金刚石的一种有趣的方法。
总之,在生物分子检测中,当权衡金刚石基电极与生物传感器时,一方面,有实际的应用价值。
▌文章来源

*部分图片来自互联网,无法核实真实出处,如涉及侵权,请直接联系删除。